कार्बन, जीवन का आधार और आधुनिक तकनीक की नींव है, जो अपने अनोखे सहसंयोजी आबंधों के कारण ही अनगिनत रूपों में मौजूद है। हीरे की कठोरता से लेकर ग्राफीन की अद्भुत चालकता तक, इसकी बहुमुखी प्रतिभा परमाणु की चार संयोजकता (valence) से आती है। यह क्षमता उसे हाइड्रोजन, ऑक्सीजन, नाइट्रोजन जैसे तत्वों से मिलकर DNA, प्रोटीन, प्लास्टिक और नई नैनो-सामग्रियां बनाने में सक्षम बनाती है। कार्बन नैनोट्यूब और 2D ग्राफीन जैसे हालिया नवाचारों ने इसकी आबंध क्षमता को पुनः उजागर किया है, जो इसे भविष्य की ऊर्जा और इलेक्ट्रॉनिक्स में केंद्रीय बनाते हैं। इस मौलिक अवधारणा को समझना हमारे संसार को जानने की कुंजी है।
रासायनिक आबंध: अणु क्यों बनते हैं?
हमारे चारों ओर की दुनिया अनगिनत पदार्थों से बनी है, और ये सभी पदार्थ परमाणुओं से मिलकर बने हैं। लेकिन ये परमाणु अकेले क्यों नहीं रहते? वे एक-दूसरे से जुड़कर अणु क्यों बनाते हैं? इसका सीधा सा जवाब है – स्थिरता। हर परमाणु चाहता है कि वह सबसे स्थिर अवस्था में रहे। इस स्थिरता को प्राप्त करने के लिए परमाणु एक-दूसरे से जुड़ते हैं, और इस जुड़ाव को ही ‘रासायनिक आबंध’ कहते हैं।
मुख्यतः दो प्रकार के रासायनिक आबंध होते हैं:
- आयनिक आबंध (Ionic Bond): इसमें एक परमाणु अपने इलेक्ट्रॉन पूरी तरह से दूसरे परमाणु को दे देता है, और इस प्रकार वे विपरीत आवेश वाले आयन बन जाते हैं जो एक-दूसरे को आकर्षित करते हैं। उदाहरण के लिए, नमक (सोडियम क्लोराइड, NaCl) में सोडियम अपना एक इलेक्ट्रॉन क्लोरीन को दे देता है।
- सहसंयोजी आबंध (Covalent Bond): इसमें परमाणु एक-दूसरे के साथ इलेक्ट्रॉन साझा करते हैं। यह साझाकरण उन्हें स्थिरता प्रदान करता है। आज हम इसी प्रकार के आबंध पर गहराई से बात करेंगे, खासकर कार्बन के संदर्भ में।
सहसंयोजी आबंध: ‘साझा करो और देखभाल करो’ का सिद्धांत
सहसंयोजी आबंध जैसा कि नाम से ही स्पष्ट है, ‘सह’ (साथ में) और ‘संयोजी’ (जोड़ने वाला) है। यह तब बनता है जब दो परमाणु अपने बाहरी कोश के इलेक्ट्रॉनों को एक-दूसरे के साथ साझा करते हैं ताकि दोनों परमाणु अपने बाहरी कोश में स्थायी विन्यास (आमतौर पर 8 इलेक्ट्रॉन, जिसे अष्टक नियम कहते हैं) प्राप्त कर सकें। यह ‘साझा करो और देखभाल करो’ (Sharing is Caring) के सिद्धांत पर काम करता है।
कल्पना कीजिए आपके पास एक खिलौना है और आपके दोस्त के पास भी एक खिलौना है। अगर आप दोनों अपने खिलौने एक-दूसरे के साथ साझा करते हैं, तो आप दोनों ही दोनों खिलौनों का आनंद ले सकते हैं। ठीक इसी तरह, परमाणु अपने इलेक्ट्रॉनों को साझा करते हैं ताकि दोनों के बाहरी कोश में पर्याप्त इलेक्ट्रॉन हो जाएं।
सहसंयोजी आबंध तीन प्रकार के हो सकते हैं, जो साझा किए गए इलेक्ट्रॉन युग्मों की संख्या पर निर्भर करते हैं:
- एकल आबंध (Single Bond): जब दो परमाणु एक-एक इलेक्ट्रॉन साझा करके एक इलेक्ट्रॉन युग्म बनाते हैं। जैसे हाइड्रोजन अणु (H-H)।
- द्वि-आबंध (Double Bond): जब दो परमाणु दो-दो इलेक्ट्रॉन साझा करके दो इलेक्ट्रॉन युग्म बनाते हैं। जैसे ऑक्सीजन अणु (O=O)।
- त्रि-आबंध (Triple Bond): जब दो परमाणु तीन-तीन इलेक्ट्रॉन साझा करके तीन इलेक्ट्रॉन युग्म बनाते हैं। जैसे नाइट्रोजन अणु (N≡N)।
कार्बन की अनूठी प्रकृति: चतुःसंयोजकता
अब बात करते हैं हमारे आज के नायक, कार्बन की। कार्बन का परमाणु क्रमांक 6 होता है, जिसका अर्थ है कि इसके नाभिक में 6 प्रोटॉन और इसके चारों ओर 6 इलेक्ट्रॉन होते हैं। इसका इलेक्ट्रॉनिक विन्यास 2, 4 है, यानी इसके पहले कोश में 2 और बाहरी कोश (जिसे संयोजी कोश भी कहते हैं) में 4 इलेक्ट्रॉन होते हैं।
यहां एक चुनौती आती है: अष्टक नियम को पूरा करने के लिए कार्बन को या तो 4 इलेक्ट्रॉन प्राप्त करने होंगे या 4 इलेक्ट्रॉन खोने होंगे।
- 4 इलेक्ट्रॉन खोना: अगर कार्बन 4 इलेक्ट्रॉन खो देता है, तो यह C4+ धनायन बनाएगा। लेकिन 4 इलेक्ट्रॉन निकालने के लिए बहुत अधिक ऊर्जा की आवश्यकता होगी, जो व्यवहार्य नहीं है।
- 4 इलेक्ट्रॉन प्राप्त करना: अगर कार्बन 4 इलेक्ट्रॉन प्राप्त कर लेता है, तो यह C4- ऋणायन बनाएगा। लेकिन 6 प्रोटॉन वाले नाभिक के लिए 10 इलेक्ट्रॉनों (6+4) को पकड़ पाना मुश्किल होगा, क्योंकि इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बहुत अधिक होगा।
तो कार्बन क्या करता है? वह ‘साझा करो और देखभाल करो’ के सिद्धांत को अपनाता है! कार्बन अपने 4 संयोजी इलेक्ट्रॉनों को अन्य परमाणुओं (कार्बन या अन्य तत्वों) के साथ साझा करता है। इस गुण को ‘चतुःसंयोजकता’ (Tetravalency) कहते हैं। कक्षा 10 विज्ञान के पाठ्यक्रम में यह अवधारणा बहुत महत्वपूर्ण है क्योंकि यह कार्बनिक रसायन विज्ञान की नींव है।
यह चतुःसंयोजकता ही कार्बन को असाधारण रूप से बहुमुखी बनाती है। वह एक साथ चार सहसंयोजी आबंध बना सकता है, जिससे वह विभिन्न प्रकार के अणुओं का निर्माण कर पाता है।
कार्बन का सहसंयोजी जादू: श्रृंखलन और समावयवता
कार्बन की चतुःसंयोजकता के कारण ही इसमें दो अद्भुत गुण पाए जाते हैं, जो इसे अन्य तत्वों से अलग बनाते हैं:
श्रृंखलन (Catenation)
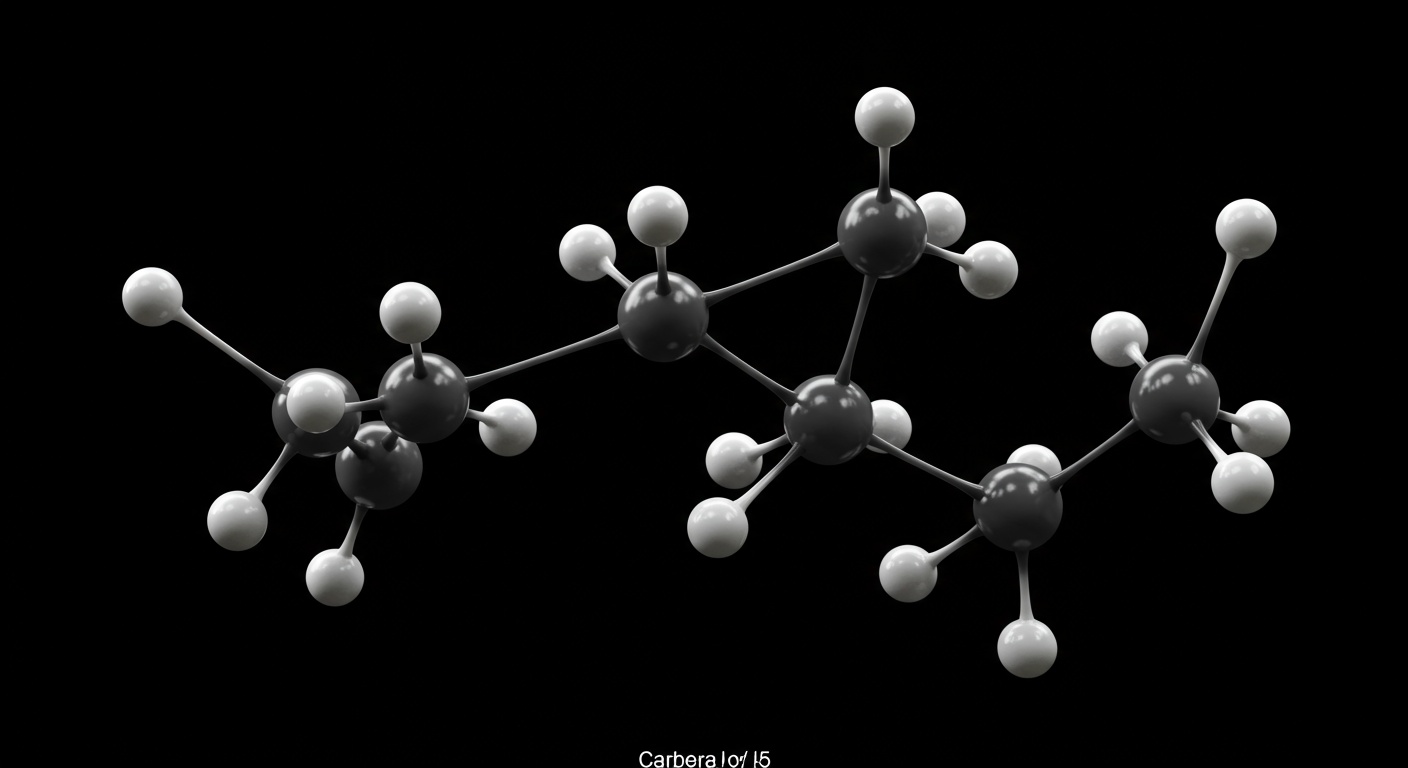
कार्बन परमाणुओं में एक-दूसरे के साथ सीधे जुड़कर लंबी श्रृंखलाएं, शाखित श्रृंखलाएं या वलय (रिंग) संरचनाएं बनाने की अद्वितीय क्षमता होती है। इस गुण को ‘श्रृंखलन’ कहते हैं। कार्बन-कार्बन आबंध बहुत मजबूत और स्थिर होते हैं, जिससे ये लंबी संरचनाएं भी स्थायी होती हैं। यह गुण ही लाखों कार्बनिक यौगिकों के अस्तित्व का आधार है।
- सीधी श्रृंखलाएं: जैसे ब्यूटेन (CH3-CH2-CH2-CH3)
- शाखित श्रृंखलाएं: जैसे आइसोब्यूटेन (CH3-CH(CH3)-CH3)
- वलय संरचनाएं: जैसे साइक्लोहेक्सेन (एक 6-कार्बन वलय)
समावयवता (Isomerism)
श्रृंखलन के कारण ही कार्बनिक यौगिकों में ‘समावयवता’ का गुण पाया जाता है। समावयवी वे यौगिक होते हैं जिनका आणविक सूत्र (molecular formula) समान होता है, लेकिन उनकी संरचनात्मक व्यवस्था (structural arrangement) भिन्न होती है। उदाहरण के लिए, ब्यूटेन और आइसोब्यूटेन दोनों का आणविक सूत्र C4H10 है, लेकिन उनकी संरचनाएं अलग-अलग हैं, जिसके कारण उनके भौतिक और रासायनिक गुण भी अलग होते हैं।
कार्बनिक यौगिकों के प्रकार और उनके अनुप्रयोग
कार्बन के सहसंयोजी आबंध और श्रृंखलन के गुणों के कारण ही कार्बनिक यौगिकों की एक विशाल श्रृंखला मौजूद है। आइए कुछ प्रमुख प्रकारों और उनके वास्तविक दुनिया के अनुप्रयोगों को देखें:
हाइड्रोकार्बन
ये वे यौगिक हैं जो केवल कार्बन और हाइड्रोजन परमाणुओं से मिलकर बने होते हैं। इन्हें आगे तीन मुख्य श्रेणियों में बांटा गया है:
- एल्केन (Alkanes): इनमें कार्बन-कार्बन एकल आबंध होते हैं (जैसे मीथेन, प्रोपेन)। ये प्राकृतिक गैस और पेट्रोलियम के मुख्य घटक हैं।
- एल्कीन (Alkenes): इनमें कम से कम एक कार्बन-कार्बन द्वि-आबंध होता है (जैसे एथीन)। इनका उपयोग प्लास्टिक बनाने में होता है।
- एल्काइन (Alkynes): इनमें कम से कम एक कार्बन-कार्बन त्रि-आबंध होता है (जैसे एथाइन)। इनका उपयोग वेल्डिंग में होता है।
क्रियात्मक समूह (Functional Groups)
जब हाइड्रोजन परमाणुओं को अन्य तत्वों (जैसे ऑक्सीजन, नाइट्रोजन, हैलोजन) वाले समूहों से प्रतिस्थापित किया जाता है, तो विभिन्न प्रकार के कार्बनिक यौगिक बनते हैं। इन समूहों को ‘क्रियात्मक समूह’ कहते हैं और ये यौगिकों के रासायनिक गुणों को निर्धारित करते हैं (जैसे अल्कोहल, कार्बोक्सिलिक अम्ल, एमीन)।
वास्तविक दुनिया में अनुप्रयोग
कार्बन के सहसंयोजी आबंध और उसके अद्वितीय गुणों के बिना हमारी आधुनिक दुनिया की कल्पना करना भी मुश्किल है। हर जगह हम इन गुणों के प्रभावों को देख सकते हैं:
- प्लास्टिक और पॉलिमर: हम जिन प्लास्टिक की बोतलों, खिलौनों, कपड़ों और पैकेजिंग सामग्री का उपयोग करते हैं, वे सभी पॉलिमर हैं। ये लंबी कार्बन श्रृंखलाओं से बने होते हैं जो सहसंयोजी आबंधों द्वारा आपस में जुड़ी होती हैं। इन आबंधों की मजबूती के कारण ही प्लास्टिक टिकाऊ होते हैं।
- ईंधन: पेट्रोल, डीजल, प्राकृतिक गैस और एलपीजी जैसे सभी ईंधन हाइड्रोकार्बन हैं। जब हम इन्हें जलाते हैं, तो कार्बन-कार्बन और कार्बन-हाइड्रोजन सहसंयोजी आबंध टूटते हैं और ऊर्जा मुक्त होती है, जिसका उपयोग हम अपने वाहनों और घरों में करते हैं।
- जैविक अणु: जीवन स्वयं कार्बन पर आधारित है! डीएनए, आरएनए, प्रोटीन, कार्बोहाइड्रेट और वसा जैसे सभी प्रमुख जैविक अणु कार्बन की लंबी और जटिल श्रृंखलाओं से बने होते हैं, जो सहसंयोजी आबंधों द्वारा एक साथ बंधे होते हैं। हमारे शरीर का हर हिस्सा इन्हीं कार्बनिक यौगिकों से बना है।
- दवाएं और दवा उत्पाद: अधिकांश दवाएं कार्बनिक यौगिक होती हैं। उनके विशिष्ट रासायनिक गुण और शरीर के साथ उनकी परस्पर क्रिया कार्बन परमाणुओं की विशिष्ट व्यवस्था और उनमें मौजूद सहसंयोजी आबंधों पर निर्भर करती है।
- हीरा और ग्रेफाइट: ये दोनों कार्बन के अपरूप (Allotropes) हैं, यानी ये केवल कार्बन परमाणुओं से बने हैं, लेकिन उनकी संरचनात्मक व्यवस्था अलग है।
विशेषता हीरा (Diamond) ग्रेफाइट (Graphite) कार्बन परमाणु की व्यवस्था प्रत्येक कार्बन 4 अन्य कार्बन से जुड़ा, चतुष्फलकीय 3D संरचना प्रत्येक कार्बन 3 अन्य कार्बन से जुड़ा, षट्कोणीय परतदार 2D संरचना आबंध मजबूत सहसंयोजी आबंध मजबूत सहसंयोजी आबंध (परतों के भीतर), परतों के बीच कमजोर वान डर वाल्स बल कठोरता अत्यंत कठोर (प्रकृति में सबसे कठोर ज्ञात पदार्थ) नरम, चिकना, आसानी से परतें फिसलती हैं विद्युत चालकता अचालक सुचालक (मुक्त इलेक्ट्रॉन के कारण) उपयोग कटाई, पॉलिशिंग, आभूषण पेंसिल लेड, स्नेहक, इलेक्ट्रोड यह तालिका दर्शाती है कि कैसे केवल आबंधों की व्यवस्था में अंतर से कार्बन के गुण कितने बदल जाते हैं।
यह महत्वपूर्ण क्यों है?
कार्बन के सहसंयोजी आबंधों और उसके अद्वितीय गुणों को समझना न केवल कक्षा 10 विज्ञान के लिए महत्वपूर्ण है, बल्कि यह हमारे आसपास की दुनिया को समझने की एक कुंजी है। जब हम इन बुनियादी सिद्धांतों को समझते हैं, तो हम यह जान पाते हैं कि प्लास्टिक कैसे बनते हैं, ईंधन हमें ऊर्जा कैसे देते हैं, और यहां तक कि हमारा अपना शरीर कैसे काम करता है। यह ज्ञान हमें नए पदार्थ विकसित करने, बीमारियों का इलाज खोजने और ऊर्जा के नए स्रोतों की खोज करने में भी मदद करता है। यह हमें एक ऐसी दुनिया में रहने में सक्षम बनाता है जो कार्बनिक रसायन विज्ञान के चमत्कारों से भरी हुई है।
निष्कर्ष
कार्बन का सहसंयोजी आबंध केवल एक रासायनिक अवधारणा नहीं, बल्कि हमारे आसपास की दुनिया को समझने की कुंजी है। आपने देखा कि कैसे कार्बन चार इलेक्ट्रॉन साझा कर अनगिनत यौगिक बनाता है, जो जीवन का आधार हैं, जैसे प्रोटीन, डीएनए और यहां तक कि प्लास्टिक भी। इस समझ को अपने दैनिक जीवन से जोड़ें; जब आप पेट्रोल या खाना खाते हैं, तो याद रखें कि यह सब कार्बन के अद्भुत सहसंयोजी आबंधों का कमाल है। मुझे याद है कि जब मैंने पहली बार ग्रेफीन जैसी सामग्री के बारे में पढ़ा, तो मुझे कार्बन की इस अनूठी क्षमता पर और भी अधिक आश्चर्य हुआ। यह दिखाता है कि कैसे एक ही तत्व विभिन्न रूपों में अद्भुत गुण प्रदर्शित कर सकता है। कार्बन की इस संरचनात्मक समझ से आप रसायन विज्ञान के जटिल पहलुओं को आसानी से सुलझा सकते हैं। यह सिर्फ एक विषय नहीं, बल्कि भविष्य की तकनीकों और स्थायी समाधानों का आधार है। तो, इस ज्ञान को आत्मसात करें और अपनी जिज्ञासा को उड़ान दें!
More Articles
आयनिक यौगिकों के गुण और विद्युत चालकता का रहस्य जानें
धातु और अधातु को कैसे पहचानें भौतिक गुणों का आसान गाइड
दैनिक जीवन में पीएच स्केल का महत्व अम्ल क्षारक संतुलन कैसे बनाएँ
साधारण नमक से बनने वाले रसायन और उनके अद्भुत उपयोग
FAQs
सहसंयोजी आबंध क्या होता है?
सहसंयोजी आबंध तब बनता है जब दो परमाणु अपने बाहरी कोश के इलेक्ट्रॉनों को आपस में साझा करते हैं ताकि वे स्थिर हो सकें और अपना अष्टक (आठ इलेक्ट्रॉन) पूरा कर सकें। इस साझाकरण से दोनों परमाणुओं को अपने बाहरी कोश में पर्याप्त इलेक्ट्रॉन मिल जाते हैं।
कार्बन आयनिक आबंध के बजाय केवल सहसंयोजी आबंध ही क्यों बनाता है?
कार्बन का परमाणु क्रमांक 6 होता है, जिसका अर्थ है कि इसके बाहरी कोश में 4 इलेक्ट्रॉन होते हैं। इसे स्थिर होने के लिए या तो 4 इलेक्ट्रॉन प्राप्त करने होंगे (C⁴⁻ बनाने के लिए) या 4 इलेक्ट्रॉन खोने होंगे (C⁴⁺ बनाने के लिए)। इन दोनों ही स्थितियों में बहुत अधिक ऊर्जा की आवश्यकता होती है, जो कार्बन के लिए संभव नहीं है। इसलिए, यह इलेक्ट्रॉनों को साझा करके सहसंयोजी आबंध बनाता है।
कार्बन सहसंयोजी आबंध बनाकर स्थिरता कैसे प्राप्त करता है?
कार्बन अन्य परमाणुओं, जैसे हाइड्रोजन, ऑक्सीजन, नाइट्रोजन या स्वयं कार्बन के परमाणुओं के साथ अपने 4 बाहरी इलेक्ट्रॉनों को साझा करता है। इस साझाकरण से कार्बन अपने बाहरी कोश में 8 इलेक्ट्रॉन (अष्टक पूर्ण) कर लेता है, जिससे वह रासायनिक रूप से स्थिर हो जाता है।
कार्बन की संयोजकता क्या है?
कार्बन की संयोजकता 4 होती है, जिसे ‘चतुर् संयोजकता’ (Tetravalency) भी कहते हैं। इसका मतलब है कि यह चार अन्य परमाणुओं के साथ सहसंयोजी आबंध बना सकता है।
कार्बन के सहसंयोजी आबंध का एक सरल उदाहरण दीजिए।
मीथेन (CH₄) कार्बन के सहसंयोजी आबंध का एक बेहतरीन उदाहरण है। इसमें एक कार्बन परमाणु चार हाइड्रोजन परमाणुओं के साथ अपने एक-एक इलेक्ट्रॉन को साझा करके चार सहसंयोजी आबंध बनाता है।
कार्बन के सहसंयोजी आबंधों से बने यौगिकों की प्रमुख विशेषताएँ क्या हैं?
इन यौगिकों के गलनांक (melting point) और क्वथनांक (boiling point) आमतौर पर कम होते हैं क्योंकि इनके अणुओं के बीच कमजोर अंतराण्विक बल होते हैं। साथ ही, ये विद्युत के कुचालक होते हैं क्योंकि इनमें कोई मुक्त आयन या इलेक्ट्रॉन नहीं होते हैं जो विद्युत का संचालन कर सकें।
कार्बन को यौगिक बनाने में इतना बहुमुखी कौन सी विशेषता बनाती है?
कार्बन की दो मुख्य विशेषताएँ इसे बहुमुखी बनाती हैं: ‘श्रृंखलन’ (Catenation) और ‘चतुर् संयोजकता’ (Tetravalency)। श्रृंखलन के कारण कार्बन के परमाणु एक-दूसरे से जुड़कर लंबी श्रृंखलाएँ, शाखाएँ या वलय बना सकते हैं। चतुर् संयोजकता के कारण यह चार अन्य परमाणुओं के साथ आबंध बना सकता है, जिससे विभिन्न प्रकार के जटिल यौगिकों का निर्माण होता है।














