हमारे दैनिक जीवन में, आपके स्मार्टफोन से लेकर घर बनाने वाले स्टील तक, हर जगह धातु और अधातु का गहरा प्रभाव दिखता है। क्या आपने कभी सोचा है कि क्यों सोना बिजली का उत्कृष्ट सुचालक है, जबकि प्लास्टिक, जो मुख्य रूप से अधातु तत्वों से बना है, कुचालक होता है? आधुनिक तकनीक में, इलेक्ट्रिक वाहनों की बैटरियों में लिथियम जैसे धातुओं का उपयोग और सौर पैनलों में सिलिकॉन जैसे अधातुओं की महत्वपूर्ण भूमिका उनके मूलभूत रासायनिक और भौतिक गुणों में निहित है। इन्हीं विशिष्ट गुणों के कारण वे अलग-अलग व्यवहार करते हैं। आइए, इन पदार्थों के निर्माण खंडों और उनके उपयोग को समझने के लिए, धातु और अधातु में अंतर को आसान शब्दों में गहराई से जानें।
धातु क्या हैं?
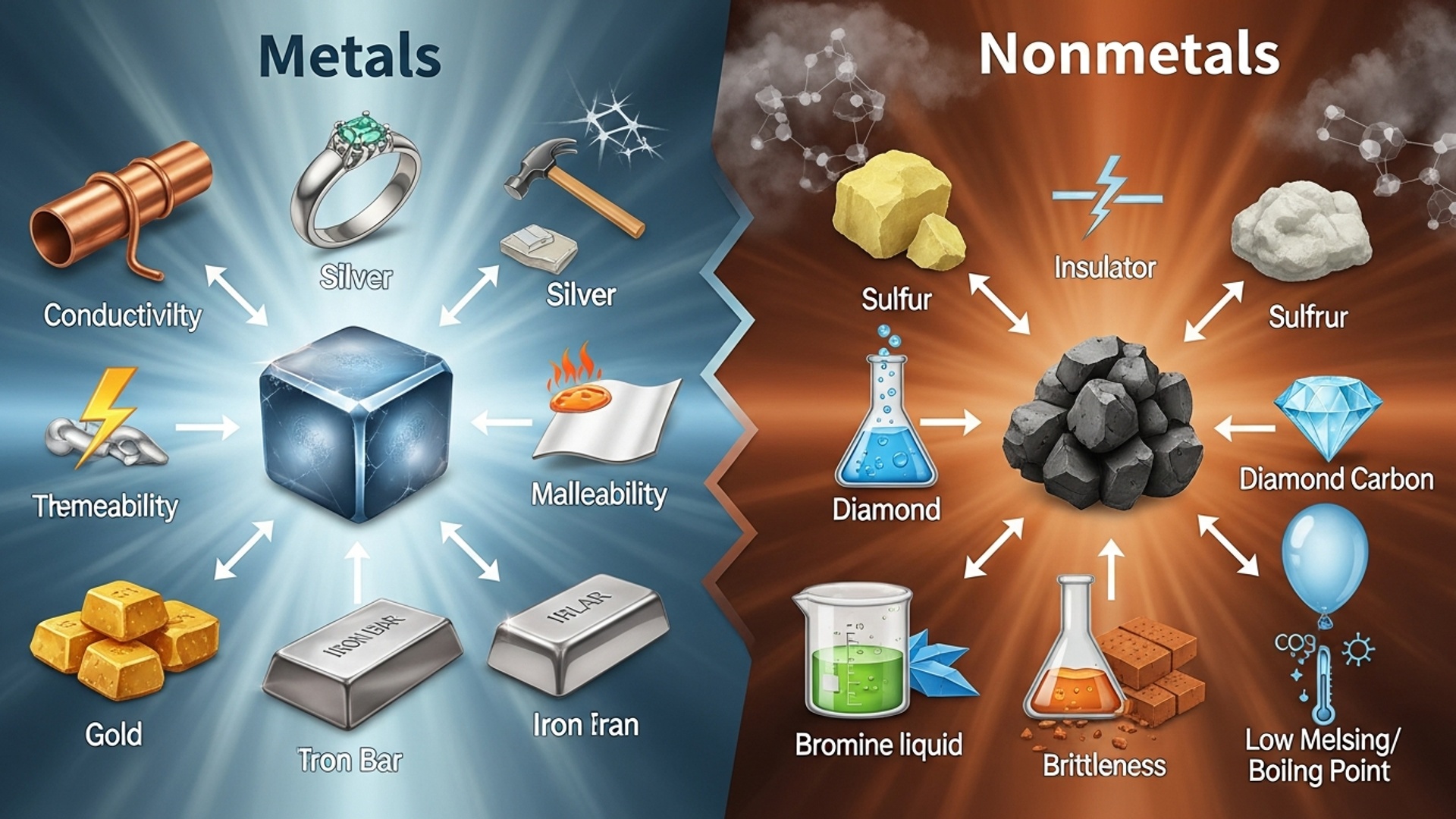
हमारे चारों ओर मौजूद वस्तुओं में से अधिकांश का निर्माण धातुओं से हुआ है, चाहे वह आपके घर में लगे बिजली के तार हों, रसोई के बर्तन हों या फिर आपके वाहन। धातुएँ वे तत्व हैं जो आवर्त सारणी (Periodic Table) के बाईं ओर और केंद्र में पाए जाते हैं। ये आमतौर पर ठोस, चमकीले, ऊष्मा और विद्युत के अच्छे सुचालक होते हैं। विज्ञान की भाषा में, धातुएँ वे तत्व हैं जिनमें धात्विक चमक, आघातवर्धनीयता (malleability), तन्यता (ductility) और ऊष्मा तथा विद्युत चालकता जैसे गुण होते हैं। इनमें इलेक्ट्रॉन त्यागने की प्रवृत्ति होती है, जिससे वे धनायन (cations) बनाते हैं। यह गुण ही उन्हें अधातुओं से अलग करता है और उनके रासायनिक व्यवहार को निर्धारित करता है।
उदाहरण के लिए, जब हम लोहे (Iron) की बात करते हैं, तो हम उसकी मजबूती, जंग लगने की प्रवृत्ति और चुम्बकीय गुणों से परिचित होते हैं। सोना (Gold) और चाँदी (Silver) अपनी चमक और आभूषणों में उपयोग के लिए जाने जाते हैं, जबकि तांबा (Copper) और एल्यूमीनियम (Aluminium) बिजली के तारों और खाना पकाने के बर्तनों में अपनी सुचालकता के कारण उपयोग होते हैं। पारा (Mercury) एक अनूठी धातु है जो कमरे के तापमान पर द्रव अवस्था में पाई जाती है, जिसका उपयोग थर्मामीटर में होता है।
प्रसिद्ध रसायनज्ञ डी. आई. मेंडेलीव (D. I. Mendeleev) ने आवर्त सारणी के विकास में धातुओं और अधातुओं के वर्गीकरण को एक महत्वपूर्ण आधार माना था। धातुओं की पहचान मुख्य रूप से उनके भौतिक और रासायनिक गुणों से की जाती है।
अधातु क्या हैं?
धातुओं के विपरीत, अधातुएँ वे तत्व हैं जो आवर्त सारणी के दाहिनी ओर पाए जाते हैं। ये भौतिक और रासायनिक गुणों में धातुओं से बिल्कुल भिन्न होते हैं। अधातुएँ आमतौर पर भंगुर (brittle) होती हैं, इनमें चमक नहीं होती (हीरे को छोड़कर), और ये ऊष्मा तथा विद्युत के कुचालक होते हैं। इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति होती है, जिससे वे ऋणायन (anions) बनाते हैं। यह गुण उन्हें आयनिक यौगिकों (ionic compounds) और सहसंयोजक यौगिकों (covalent compounds) के निर्माण में महत्वपूर्ण भूमिका निभाने में सक्षम बनाता है।
अधातुएँ विभिन्न भौतिक अवस्थाओं में पाई जा सकती हैं। उदाहरण के लिए, ऑक्सीजन (Oxygen) और नाइट्रोजन (Nitrogen) कमरे के तापमान पर गैसें हैं, जो हमारे वायुमंडल का एक बड़ा हिस्सा बनाती हैं और जीवन के लिए आवश्यक हैं। ब्रोमीन (Bromine) एक ऐसी अधातु है जो कमरे के तापमान पर द्रव अवस्था में पाई जाती है। कार्बन (Carbon), सल्फर (Sulphur) और फास्फोरस (Phosphorus) जैसे तत्व ठोस अधातुएँ हैं। कार्बन के विभिन्न अपररूप (allotropes) जैसे हीरा (Diamond) और ग्रेफाइट (Graphite) अधातुओं के उल्लेखनीय उदाहरण हैं। हीरा अपनी कठोरता और चमक के लिए जाना जाता है, जबकि ग्रेफाइट विद्युत का सुचालक है, जो इसे बैटरी और पेंसिल लेड में उपयोगी बनाता है।
अधातुएँ हमारे दैनिक जीवन में उतनी ही महत्वपूर्ण हैं जितनी धातुएँ। वे जैविक अणुओं (जैसे प्रोटीन, न्यूक्लिक एसिड) का आधार बनती हैं, और कई औद्योगिक प्रक्रियाओं में भी महत्वपूर्ण भूमिका निभाती हैं, जैसे अमोनिया के उत्पादन में नाइट्रोजन का उपयोग।
धातु और अधातु के बीच मुख्य अंतर
धातुओं और अधातुओं के बीच के अंतर को समझना रसायन विज्ञान की आधारशिला है। ये अंतर केवल उनके उपयोग को ही नहीं, बल्कि उनके रासायनिक व्यवहार और प्रकृति को भी परिभाषित करते हैं। आइए, धातु और अधातु में अंतर को एक विस्तृत तालिका के माध्यम से समझते हैं:
| गुणधर्म | धातु (Metals) | अधातु (Non-metals) |
|---|---|---|
| भौतिक अवस्था | कमरे के तापमान पर अधिकांश धातुएँ ठोस होती हैं (पारा अपवाद है)। | कमरे के तापमान पर ये ठोस, द्रव या गैस हो सकते हैं (कार्बन, सल्फर ठोस; ब्रोमीन द्रव; ऑक्सीजन, नाइट्रोजन गैस)। |
| चमक (Lustre) | इनमें धात्विक चमक होती है (चमकीले होते हैं)। | इनमें कोई धात्विक चमक नहीं होती (हीरा और आयोडीन अपवाद हैं)। |
| कठोरता (Hardness) | आम तौर पर कठोर होते हैं (सोडियम और पोटेशियम अपवाद हैं)। | आम तौर पर नरम और भंगुर होते हैं (हीरा अपवाद है)। |
| आघातवर्धनीयता (Malleability) | इन्हें पीटकर पतली चादरों में बदला जा सकता है। | ये आघातवर्धनीय नहीं होते, पीटने पर टूट जाते हैं (भंगुर होते हैं)। |
| तन्यता (Ductility) | इन्हें खींचकर पतले तारों में बदला जा सकता है। | ये तन्य नहीं होते। |
| ऊष्मा चालकता (Thermal Conductivity) | ऊष्मा के अच्छे सुचालक होते हैं। | ऊष्मा के कुचालक होते हैं (ग्रेफाइट अपवाद है)। |
| विद्युत चालकता (Electrical Conductivity) | विद्युत के अच्छे सुचालक होते हैं। | विद्युत के कुचालक होते हैं (ग्रेफाइट अपवाद है)। |
| घनत्व (Density) | आम तौर पर उच्च घनत्व वाले होते हैं। | आम तौर पर कम घनत्व वाले होते हैं। |
| गलनांक और क्वथनांक | उच्च गलनांक और क्वथनांक होते हैं। | कम गलनांक और क्वथनांक होते हैं (कुछ अपवादों को छोड़कर)। |
| ध्वनि (Sonority) | इनमें धात्विक ध्वनि होती है (घंटी जैसी आवाज)। | इनमें धात्विक ध्वनि नहीं होती। |
| इलेक्ट्रॉन त्यागने/ग्रहण करने की प्रवृत्ति | इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति होती है। | इलेक्ट्रॉन ग्रहण कर ऋणायन बनाने की प्रवृत्ति होती है। |
| ऑक्साइड की प्रकृति | इनके ऑक्साइड आमतौर पर क्षारीय (basic) होते हैं (कुछ उभयधर्मी भी होते हैं)। | इनके ऑक्साइड आमतौर पर अम्लीय (acidic) होते हैं (कुछ उदासीन भी होते हैं)। |
| अम्लों के साथ अभिक्रिया | अम्लों के साथ अभिक्रिया करके हाइड्रोजन गैस उत्पन्न करते हैं। | अम्लों के साथ अभिक्रिया नहीं करते (कुछ विशेष परिस्थितियों में ही)। |
उपयोग और अनुप्रयोग
धातुओं और अधातुओं के विशिष्ट गुणों के कारण, उनके अनुप्रयोग हमारे जीवन के हर पहलू में फैले हुए हैं।
धातुओं के अनुप्रयोग:
- निर्माण और इंजीनियरिंग
- विद्युत उद्योग
- आभूषण और सजावट
- घरेलू उपयोग
- औद्योगिक उपयोग
लोहा, इस्पात (लोहे का एक मिश्रधातु), और एल्यूमीनियम का उपयोग पुलों, इमारतों, वाहनों, हवाई जहाजों और मशीनों के निर्माण में होता है। उनकी मजबूती, स्थायित्व और आघातवर्धनीयता उन्हें इन कार्यों के लिए आदर्श बनाती है।
तांबा और एल्यूमीनियम अपनी उत्कृष्ट विद्युत चालकता के कारण बिजली के तारों, केबलों और इलेक्ट्रॉनिक उपकरणों में व्यापक रूप से उपयोग किए जाते हैं।
सोना, चाँदी और प्लेटिनम अपनी चमक, संक्षारण प्रतिरोध और सुंदरता के कारण आभूषणों में अत्यधिक मूल्यवान हैं।
स्टेनलेस स्टील (एक लोहे का मिश्रधातु) का उपयोग रसोई के बर्तनों, कटलरी और उपकरणों में होता है क्योंकि यह जंग प्रतिरोधी होता है और साफ करना आसान होता है।
जिंक का उपयोग गैल्वनीकरण (galvanization) में लोहे को जंग से बचाने के लिए होता है। टिन का उपयोग खाद्य डिब्बों की कोटिंग के लिए होता है।
अधातुओं के अनुप्रयोग:
- जीवन का आधार
- औद्योगिक रसायन
- कृषि
- ईंधन
- इलेक्ट्रॉनिक्स
ऑक्सीजन श्वसन के लिए आवश्यक है, जबकि नाइट्रोजन प्रोटीन और न्यूक्लिक एसिड का एक महत्वपूर्ण घटक है, जो सभी जीवित जीवों में पाए जाते हैं। कार्बन सभी कार्बनिक यौगिकों का आधार है।
क्लोरीन का उपयोग जल शोधन (water purification) में कीटाणुनाशक के रूप में और ब्लीच के उत्पादन में होता है। सल्फर का उपयोग सल्फ्यूरिक एसिड के निर्माण में होता है, जो कई उद्योगों का “राजा रसायन” है।
नाइट्रोजन और फास्फोरस उर्वरकों के प्रमुख घटक हैं, जो फसलों की वृद्धि के लिए आवश्यक हैं।
प्राकृतिक गैस (मुख्य रूप से मीथेन, एक कार्बनिक अधातु यौगिक) और कोयला (मुख्य रूप से कार्बन) ऊर्जा के प्रमुख स्रोत हैं।
सिलिकॉन, एक उपधातु (metalloid), अर्धचालक उद्योग की रीढ़ है और कंप्यूटर चिप्स तथा सोलर पैनल में इसका व्यापक रूप से उपयोग होता है। ग्रेफाइट, कार्बन का एक अपररूप, इलेक्ट्रोड और स्नेहक के रूप में उपयोग होता है।
हमारे चारों ओर की दुनिया धातुओं और अधातुओं के अनूठे गुणों और उनके बीच के महत्वपूर्ण अंतरों का परिणाम है। इन तत्वों की समझ हमें नई सामग्रियों को विकसित करने और प्रौद्योगिकी में आगे बढ़ने में मदद करती है। ‘dhatu aur adhatu mein antar’ की यह विस्तृत जानकारी आपको रसायन विज्ञान की इस मूलभूत अवधारणा को स्पष्ट रूप से समझने में सहायक होगी।
निष्कर्ष
इस चर्चा से हमने समझा कि धातु और अधातु सिर्फ रासायनिक तत्व नहीं, बल्कि हमारे दैनिक जीवन का अभिन्न अंग हैं। जहाँ धातुएँ अपनी चमक, चालकता और मजबूती से हमारे घरों से लेकर उद्योगों तक में क्रांति लाती हैं, वहीं अधातुएँ (जैसे ऑक्सीजन) जीवन का आधार हैं या (जैसे कार्बन) आधुनिक तकनीक का महत्वपूर्ण हिस्सा। अगली बार जब आप अपनी रसोई में स्टील का बर्तन देखें या अपनी साइकिल के फ्रेम को छूएँ, तो धातु के इन अद्भुत गुणों को याद करें। ठीक वैसे ही, जैसे कंप्यूटर चिप्स में सिलिकॉन (एक उपधातु) का उपयोग, या नई बैटरी तकनीकों में लिथियम जैसे धातुओं की बढ़ती भूमिका, यह दर्शाती है कि इनकी समझ कितनी आवश्यक है। मेरा व्यक्तिगत सुझाव है कि आप अपने आस-पास की चीजों में इन भेदों को पहचानने का प्रयास करें; यह न केवल आपकी वैज्ञानिक सोच को मजबूत करेगा, बल्कि आपको दुनिया को एक नई नज़र से देखने में मदद करेगा। याद रखें, ज्ञान की यह छोटी सी चिंगारी बड़े आविष्कारों की नींव बन सकती है। अधिक जानकारी के लिए आप खुश रहने के आसान तरीके भी पढ़ सकते हैं।
अन्य लेख
रूसी क्रांति के मुख्य कारण और इसका दुनिया पर असर
साइलेंट वैली आंदोलन पर्यावरण बचाने की एक मिसाल
शरणार्थी समस्या विश्वव्यापी चुनौती कारण और समाधान
तर्पण क्यों और कैसे किया जाता है संपूर्ण जानकारी
आज की बड़ी ख़बरें तुरंत जानें
FAQs
धातु और अधातु क्या होती हैं, बिल्कुल आसान भाषा में समझाइए?
देखिए, हमारे आसपास जितनी भी चीजें हैं, उनमें से कुछ धातुएं होती हैं और कुछ अधातुएं। धातुएं वो होती हैं जो आमतौर पर चमकीली दिखती हैं, जैसे सोना, चांदी, लोहा। ये बिजली और गर्मी की अच्छी चालक होती हैं। वहीं, अधातुएं वो होती हैं जो अक्सर चमकीली नहीं होतीं, आसानी से टूट जाती हैं और बिजली या गर्मी को अच्छे से पास नहीं होने देतीं।
धातुओं की क्या पहचान होती है? उनके कुछ खास गुण बताएं।
धातुओं को पहचानना काफी आसान है। पहला, वे आमतौर पर चमकीली होती हैं (जैसे स्टील के बर्तन)। दूसरा, उन्हें पीटकर पतली चादरें बनाई जा सकती हैं (सोने के गहने)। तीसरा, उनके तार खींचे जा सकते हैं (बिजली के तार तांबे के होते हैं)। चौथा और सबसे महत्वपूर्ण, वे बिजली और गर्मी की अच्छी चालक होती हैं।
अधातुओं में कौन से गुण होते हैं, जो उन्हें धातुओं से अलग बनाते हैं?
अधातुएं धातुओं से काफी अलग होती हैं। ये चमकीली नहीं होतीं (जैसे कोयला)। इन्हें पीटने पर ये टूट जाती हैं, यानी भंगुर होती हैं। ये बिजली और गर्मी की खराब चालक होती हैं (लकड़ी या प्लास्टिक)। अधातुएं ठोस, तरल या गैसीय तीनों अवस्थाओं में मिल सकती हैं, जबकि धातुएं ज्यादातर ठोस होती हैं।
धातु और अधातु में सबसे बड़ा और मुख्य अंतर क्या है?
सबसे बड़ा और मुख्य अंतर उनकी चालकता (conductivity) में है। धातुएं बिजली और गर्मी की बहुत अच्छी चालक होती हैं, यानी वे बिजली और गर्मी को अपने अंदर से आसानी से गुजरने देती हैं। इसके उलट, अधातुएं आमतौर पर बिजली और गर्मी की खराब चालक या कुचालक होती हैं, यानी वे इन्हें अपने अंदर से गुजरने नहीं देतीं।
क्या आप धातु और अधातु के कुछ आम उदाहरण दे सकते हैं जो हम रोज देखते हैं?
क्यों नहीं! धातुओं के उदाहरण हैं: लोहा (दरवाजे, खिड़कियां), तांबा (बिजली के तार), एल्युमीनियम (बर्तन, फॉइल), सोना और चांदी (गहने)। अधातुओं के उदाहरण हैं: ऑक्सीजन (हवा में सांस लेते हैं), नाइट्रोजन (हवा का एक और हिस्सा), कार्बन (पेंसिल की नोक में ग्रेफाइट), सल्फर (दवाओं में)।
क्या कोई ऐसी अधातु है जो बिजली चलाती है?
हाँ, बिल्कुल! वैसे तो ज्यादातर अधातुएं बिजली की कुचालक होती हैं, लेकिन इसका एक खास अपवाद है – ग्रेफाइट। यह कार्बन का एक रूप है और यह बिजली का अच्छा चालक होता है। यही वजह है कि इसे पेंसिल की नोक और कुछ बैटरियों में इस्तेमाल किया जाता है।
हम किसी चीज़ को देखकर कैसे पहचान सकते हैं कि वह धातु है या अधातु?
पहचानने का तरीका आसान है: अगर कोई चीज़ चमकीली है, उसे पीटने पर टूटती नहीं बल्कि फैलती है, उसके तार खींचे जा सकते हैं और वह बिजली या गर्मी को आसानी से पास होने देती है, तो वह धातु है। अगर वह चमकीली नहीं है, पीटने पर टूट जाती है, और बिजली या गर्मी को पास नहीं होने देती, तो वह अधातु है।
















