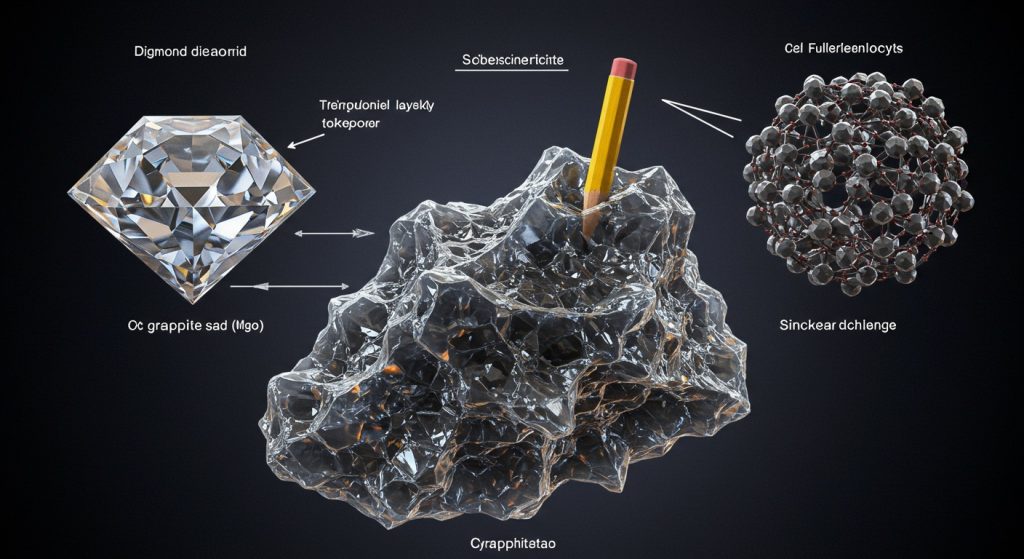
कार्बन, एक ऐसा अद्भुत तत्व जो प्रकृति में सबसे कठोर पदार्थ हीरा और सबसे नरम व सुचालक ग्रेफाइट दोनों का आधार है। इन अपररूपों में परमाणुओं की व्यवस्था ही इनके असाधारण गुणों का रहस्य है। जहाँ हीरा अपनी अविश्वसनीय कठोरता के कारण आभूषणों से लेकर औद्योगिक कटाई और अब उच्च-शक्ति वाले सेमीकंडक्टरों में भी अपनी जगह बना रहा है, वहीं ग्रेफाइट अपनी सुचालकता और चिकनाई के चलते पेंसिल की नोक से लेकर लिथियम-आयन बैटरी और 2D सामग्री ग्राफीन के रूप में इलेक्ट्रॉनिक्स में क्रांति ला रहा है। यह विरोधाभास हमें कार्बन की अद्वितीय बहुमुखी प्रतिभा और उसके उपयोगों की गहन समझ प्रदान करता है।
अपररूप क्या होते हैं?
रसायन विज्ञान में, अपररूप (Allotropes) एक ही रासायनिक तत्व के विभिन्न रूपों को कहते हैं। इन रूपों के भौतिक गुण (जैसे रंग, कठोरता, घनत्व) भले ही अलग-अलग हों, लेकिन उनकी रासायनिक संरचना (परमाणुओं का प्रकार) और रासायनिक गुण समान होते हैं। यह भिन्नता परमाणुओं की व्यवस्था में अंतर के कारण होती है। उदाहरण के लिए, ऑक्सीजन के दो अपररूप हैं: सामान्य ऑक्सीजन (O2) जिसे हम सांस लेते हैं, और ओजोन (O3), जो वातावरण की ऊपरी परतों में पाई जाती है। कार्बन भी ऐसा ही एक अद्भुत तत्व है जिसके कई अपररूप मौजूद हैं, जिनमें से हीरा और ग्रेफाइट सबसे प्रसिद्ध हैं।
कार्बन और उसकी अनूठी प्रकृति
कार्बन एक ऐसा तत्व है जो अपने अद्भुत गुणों के कारण हमारे ग्रह पर जीवन का आधार है। इसका परमाणु क्रमांक 6 है और इसकी संयोजकता (valency) 4 होती है। इसका मतलब है कि एक कार्बन परमाणु चार अन्य परमाणुओं के साथ बंधन बना सकता है। कार्बन की सबसे खास विशेषताओं में से एक इसकी ‘शृंखलन’ (catenation) की क्षमता है, यानी यह लंबे, जटिल, और स्थिर श्रृंखलाएं, शाखाएं, और वलय (rings) बना सकता है। यह गुण उसे विभिन्न प्रकार के यौगिकों (organic compounds) को बनाने में सक्षम बनाता है, जो हमारे शरीर से लेकर प्लास्टिक और ईंधन तक हर जगह मौजूद हैं। कक्षा 10 विज्ञान में कार्बन और उसके यौगिकों के बारे में विस्तार से पढ़ाया जाता है, और उसके अपररूप इसी अध्ययन का एक महत्वपूर्ण हिस्सा हैं।
हीरा: सबसे कठोर ज्ञात पदार्थ
हीरा, जिसे हम अक्सर आभूषणों में देखते हैं, कार्बन का एक अद्भुत अपररूप है। यह प्रकृति में पाया जाने वाला सबसे कठोर ज्ञात पदार्थ है।
- संरचना: हीरे में प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं के साथ सहसंयोजक बंधों (covalent bonds) द्वारा जुड़ा होता है। यह एक त्रिविमीय (three-dimensional) जालीदार संरचना बनाता है, जिसे टेट्राहेड्रल (tetrahedral) व्यवस्था कहते हैं। यह अत्यधिक मजबूत और स्थिर संरचना ही हीरे को उसकी अद्वितीय कठोरता प्रदान करती है।
- गुण:
- अत्यधिक कठोर: मोह्स कठोरता पैमाने पर 10, जो इसे सबसे कठोर प्राकृतिक सामग्री बनाता है।
- उच्च गलनांक और क्वथनांक: इसकी मजबूत संरचना के कारण।
- विद्युत का कुचालक: इसमें कोई मुक्त इलेक्ट्रॉन नहीं होते हैं, इसलिए यह बिजली का संचालन नहीं करता।
- पारदर्शी और चमकदार: इसकी उच्च अपवर्तक सूचकांक (refractive index) के कारण यह प्रकाश को प्रभावी ढंग से मोड़ता है, जिससे यह चमकता है।
- उत्कृष्ट ऊष्मा चालक: हालांकि यह बिजली का कुचालक है, यह ऊष्मा का एक बहुत अच्छा चालक है।
- उपयोग:
- औद्योगिक कटाई और ड्रिलिंग: इसकी कठोरता के कारण, हीरे का उपयोग कांच, पत्थर, धातुओं और चट्टानों को काटने, पीसने और ड्रिल करने वाले उपकरणों में किया जाता है। मेरे एक परिचित ने बताया कि कैसे उनकी कंस्ट्रक्शन कंपनी में हीरे के ब्लेड वाली आरी का उपयोग कंक्रीट को आसानी से काटने के लिए किया जाता है।
- आभूषण: इसकी चमक और स्थायित्व के कारण यह सबसे लोकप्रिय रत्नों में से एक है।
- चिकित्सा उपकरण: सूक्ष्म शल्य चिकित्सा (micro-surgery) में उपयोग होने वाले कुछ ब्लेड में भी हीरे का उपयोग होता है।
- पॉलिशिंग और अपघर्षक: हीरे के चूर्ण का उपयोग अन्य कठोर सामग्रियों को पॉलिश करने के लिए किया जाता है।
- इलेक्ट्रॉनिक्स: कुछ उच्च-शक्ति वाले इलेक्ट्रॉनिक उपकरणों में ऊष्मा सिंक (heat sinks) के रूप में।
ग्रेफाइट: नरम और सुचालक अपररूप
हीरे के बिल्कुल विपरीत, ग्रेफाइट कार्बन का एक और प्रमुख अपररूप है, जो अपने नरम और फिसलन वाले गुणों के लिए जाना जाता है।
- संरचना: ग्रेफाइट में कार्बन परमाणु षट्कोणीय वलय (hexagonal rings) में व्यवस्थित होते हैं और परतों (layers) के रूप में होते हैं। प्रत्येक कार्बन परमाणु अपनी परत में तीन अन्य कार्बन परमाणुओं से जुड़ा होता है। इन परतों के बीच कमजोर वैन डेर वाल्स बल (Van der Waals forces) होते हैं, जिससे परतें एक-दूसरे पर आसानी से फिसल सकती हैं।
- गुण:
- नरम और फिसलन वाला: परतों के बीच कमजोर बंधन के कारण। यही कारण है कि पेंसिल से लिखने पर ग्रेफाइट की परतें कागज पर छूट जाती हैं।
- विद्युत का सुचालक: प्रत्येक कार्बन परमाणु के पास एक मुक्त इलेक्ट्रॉन होता है जो परतों के बीच घूम सकता है, जिससे यह बिजली का अच्छा सुचालक बन जाता है।
- काला और अपारदर्शी: प्रकाश को अवशोषित करता है।
- उच्च गलनांक: हीरे की तरह, ग्रेफाइट का भी गलनांक बहुत अधिक होता है।
- ऊष्मा का सुचालक: यह ऊष्मा का भी अच्छा चालक है।
- उपयोग:
- पेंसिल की लीड: हम सभी बचपन से पेंसिल का उपयोग करते आ रहे हैं। इसमें उपयोग होने वाली ‘लीड’ ग्रेफाइट और चिकनी मिट्टी का मिश्रण होती है।
- स्नेहक (Lubricants): इसकी फिसलन प्रकृति के कारण, ग्रेफाइट का उपयोग मशीनों में शुष्क स्नेहक के रूप में किया जाता है, खासकर उन जगहों पर जहां तेल का उपयोग नहीं किया जा सकता।
- इलेक्ट्रोड: इसकी विद्युत चालकता के कारण, ग्रेफाइट का उपयोग बैटरी, इलेक्ट्रोलीज़ और इलेक्ट्रिक आर्क भट्टियों में इलेक्ट्रोड के रूप में व्यापक रूप से किया जाता है।
- परमाणु रिएक्टर: परमाणु रिएक्टरों में न्यूट्रॉन मंदक (neutron moderator) के रूप में।
- रिफ्रैक्ट्री सामग्री: उच्च तापमान वाले भट्टियों और क्रूसिबल (crucibles) बनाने में।
- कार्बन ब्रश: इलेक्ट्रिक मोटर्स और जनरेटर में कार्बन ब्रश के रूप में।
हीरा बनाम ग्रेफाइट: एक अद्भुत तुलना
हीरा और ग्रेफाइट दोनों ही कार्बन के अपररूप हैं, लेकिन उनकी संरचनात्मक व्यवस्था में अंतर के कारण उनके गुणों और उपयोगों में जमीन-आसमान का फर्क होता है।
| गुण | हीरा | ग्रेफाइट |
|---|---|---|
| संरचना | प्रत्येक कार्बन परमाणु 4 अन्य कार्बन परमाणुओं से सहसंयोजक बंधों द्वारा जुड़ा होता है, त्रिविमीय टेट्राहेड्रल जाली संरचना। | कार्बन परमाणु षट्कोणीय वलय बनाते हैं, जो कमजोर वैन डेर वाल्स बलों द्वारा जुड़ी परतों में व्यवस्थित होते हैं। |
| कठोरता | अत्यधिक कठोर (सबसे कठोर ज्ञात पदार्थ)। | नरम और फिसलन वाला। |
| विद्युत चालकता | विद्युत का कुचालक (कोई मुक्त इलेक्ट्रॉन नहीं)। | विद्युत का सुचालक (मुक्त इलेक्ट्रॉन मौजूद)। |
| घनत्व | उच्च (लगभग 3. 5 g/cm3)। | कम (लगभग 2. 2 g/cm3)। |
| उपयोग | कटाई, ड्रिलिंग, आभूषण, अपघर्षक। | पेंसिल, स्नेहक, इलेक्ट्रोड, परमाणु रिएक्टर। |
| रंग/रूप | पारदर्शी, चमकदार। | काला, अपारदर्शी। |
हीरा और ग्रेफाइट से परे: कार्बन के अन्य अपररूप
कार्बन के अपररूप सिर्फ हीरा और ग्रेफाइट तक ही सीमित नहीं हैं। विज्ञान में हुई प्रगति ने कई अन्य अद्भुत अपररूपों की खोज की है, जिनमें से कुछ प्रमुख हैं:
- फुलेरीन (Fullerenes): ये कार्बन के ऐसे अपररूप हैं जो खोखले गोले, दीर्घवृत्त या ट्यूब के आकार के होते हैं। सबसे प्रसिद्ध फुलेरीन बकमिनस्टरफुलेरीन (C60) है, जिसका आकार फुटबॉल जैसा होता है। इनकी खोज 1985 में हुई थी और इसके लिए वैज्ञानिकों को नोबेल पुरस्कार से सम्मानित किया गया था।
- उपयोग: नैनोटेक्नोलॉजी, दवा वितरण प्रणाली, सुपरकंडक्टर्स और उत्प्रेरक में संभावित उपयोग।
- ग्राफीन (Graphene): यह ग्रेफाइट की एक एकल परत है, यानी कार्बन परमाणुओं की एक-परत वाली षट्कोणीय जाली। इसे 2004 में खोजा गया था और इसकी अद्वितीय गुणों के कारण इसे ‘वंडर मटेरियल’ कहा जाता है।
- गुण: यह अब तक ज्ञात सबसे पतली सामग्री है, स्टील से 200 गुना मजबूत है, और बिजली तथा ऊष्मा का उत्कृष्ट चालक है।
- उपयोग: अगली पीढ़ी के इलेक्ट्रॉनिक्स, अल्ट्रा-फास्ट ट्रांजिस्टर, लचीले डिस्प्ले, सौर सेल और उन्नत सेंसर में इसका व्यापक उपयोग देखा जा रहा है।
- कार्बन नैनोट्यूब (Carbon Nanotubes): ये ग्राफीन की चादरों को बेलनाकार रूप में मोड़ने से बनते हैं।
- गुण: अत्यधिक मजबूत, बहुत हल्के और उत्कृष्ट विद्युत चालक।
- उपयोग: सामग्री विज्ञान, इलेक्ट्रॉनिक्स, चिकित्सा और ऊर्जा भंडारण में।
हमारे दैनिक जीवन में व्यावहारिक अनुप्रयोग
कार्बन के ये अपररूप, विशेष रूप से हीरा और ग्रेफाइट, हमारे दैनिक जीवन और औद्योगिक प्रक्रियाओं में अविश्वसनीय रूप से महत्वपूर्ण भूमिका निभाते हैं। जहां हीरा अपनी कठोरता के कारण औद्योगिक कटाई और उच्च-प्रौद्योगिकी अनुप्रयोगों में अनिवार्य है, वहीं ग्रेफाइट अपनी विद्युत चालकता और स्नेहक गुणों के कारण पेंसिल से लेकर उन्नत बैटरी तक हर जगह मौजूद है। कक्षा 10 विज्ञान में इन अपररूपों का अध्ययन हमें बताता है कि कैसे एक ही तत्व, परमाणुओं की अलग-अलग व्यवस्था के कारण, इतने विविध और महत्वपूर्ण गुण प्रदर्शित कर सकता है। यह समझना कि ये पदार्थ कैसे काम करते हैं, हमें नई प्रौद्योगिकियों को विकसित करने और मौजूदा समस्याओं का समाधान खोजने में मदद करता है।
निष्कर्ष
इस अद्भुत यात्रा में हमने देखा कि कैसे कार्बन, जो हमारे जीवन का आधार है, दो बिल्कुल भिन्न रूपों – हीरे और ग्रेफाइट – में मौजूद होकर अपनी बहुमुखी प्रतिभा का परिचय देता है। यह वास्तव में विस्मयकारी है कि कैसे सिर्फ परमाणुओं की व्यवस्था बदलने से एक पदार्थ (हीरा) दुनिया का सबसे कठोर तत्व बन जाता है, जिसका उपयोग पत्थरों की कटाई से लेकर अत्याधुनिक लेजर ऑप्टिक्स तक में होता है, वहीं दूसरा (ग्रेफाइट) इतना नरम और विद्युत का सुचालक होता है, जो पेंसिल की नोक से लेकर आधुनिक लिथियम-आयन बैटरी और इलेक्ट्रिक वाहनों तक में महत्वपूर्ण भूमिका निभाता है। हाल के वर्षों में, ग्रेफीन जैसे नए कार्बन अपररूपों ने इलेक्ट्रॉनिक्स और सामग्री विज्ञान में क्रांति लाई है, जो इस बात का प्रमाण है कि कार्बन की दुनिया में अभी भी कितनी अनसुनी संभावनाएं छिपी हैं। मेरा व्यक्तिगत अनुभव है कि जब हम इन मूलभूत संरचनाओं को समझते हैं, तो हमारे आसपास की दुनिया के प्रति हमारी जिज्ञासा और बढ़ जाती है। अगली बार जब आप अपनी पेंसिल से कुछ लिखें या अपने स्मार्टफोन को चार्ज करें, तो उस छोटे से कार्बन परमाणु की अद्भुत शक्ति और बहुमुखी प्रतिभा के बारे में सोचें। यह ज्ञान न केवल हमारी वैज्ञानिक समझ को गहरा करता है, बल्कि हमें यह भी सिखाता है कि कैसे एक ही आधारभूत चीज़ विभिन्न परिस्थितियों में ढलकर असाधारण परिणाम दे सकती है। अपनी जिज्ञासा को हमेशा जीवित रखें और विज्ञान के इस रोमांचक सफर को जारी रखें!
More Articles
धातु और अधातु को कैसे पहचानें भौतिक गुणों का आसान गाइड
अयस्क खनिज और गैंग धातु विज्ञान में क्यों महत्वपूर्ण हैं
मिश्रधातुएं क्या हैं और धातुओं को बेहतर कैसे बनाती हैं
क्रिस्टलन का जल क्या है और यह पदार्थों का रंग कैसे बदलता है
धातुओं के निष्कर्षण की पूरी प्रक्रिया सक्रियता श्रेणी से समझें
FAQs
कार्बन के अपररूप क्या होते हैं और हीरा, ग्रेफाइट कैसे इसके उदाहरण हैं?
कार्बन के अपररूप वे विभिन्न रूप होते हैं जिनमें कार्बन परमाणु अलग-अलग तरीकों से व्यवस्थित होकर विभिन्न भौतिक गुणों वाले पदार्थ बनाते हैं, जबकि उनके रासायनिक गुण समान रहते हैं। हीरा और ग्रेफाइट कार्बन के दो सबसे प्रसिद्ध अपररूप हैं।
हीरे को प्रकृति का सबसे कठोर पदार्थ क्यों माना जाता है?
हीरा अपनी अत्यधिक कठोरता के लिए जाना जाता है क्योंकि इसके कार्बन परमाणु एक मजबूत, त्रि-आयामी (3D) जाली संरचना में कसकर बंधे होते हैं, जहाँ प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं से सहसंयोजक बंधों (covalent bonds) द्वारा जुड़ा होता है। इस मजबूत बॉन्डिंग के कारण इसे तोड़ना बेहद मुश्किल होता है।
हीरे के प्रमुख उपयोग क्या-क्या हैं?
अपनी कठोरता के कारण, हीरे का उपयोग सिर्फ आभूषणों में ही नहीं, बल्कि औद्योगिक क्षेत्रों में भी व्यापक रूप से होता है। इसका उपयोग काटने, पीसने, ड्रिल करने और पॉलिश करने वाले उपकरणों में किया जाता है, जैसे कि पत्थर काटने वाले ब्लेड, ड्रिल बिट्स और अपघर्षक (abrasives)।
ग्रेफाइट, हीरे से किस प्रकार भिन्न है, जबकि दोनों कार्बन से ही बने हैं?
ग्रेफाइट और हीरा दोनों कार्बन के अपररूप हैं, लेकिन उनकी परमाणु संरचना में अंतर होता है। हीरे में कार्बन परमाणु एक त्रि-आयामी जाली में होते हैं, जबकि ग्रेफाइट में कार्बन परमाणु षट्कोणीय (hexagonal) परतों में व्यवस्थित होते हैं। ये परतें एक-दूसरे पर आसानी से फिसल सकती हैं, जिससे ग्रेफाइट नरम और चिकना होता है, जबकि हीरा कठोर होता है।
ग्रेफाइट बिजली का अच्छा सुचालक क्यों होता है?
ग्रेफाइट बिजली का अच्छा सुचालक इसलिए है क्योंकि इसकी षट्कोणीय परतों में प्रत्येक कार्बन परमाणु केवल तीन अन्य कार्बन परमाणुओं से जुड़ा होता है, जिससे एक मुक्त इलेक्ट्रॉन उपलब्ध रहता है। ये मुक्त इलेक्ट्रॉन परतों के भीतर आसानी से घूम सकते हैं और विद्युत धारा का संचालन कर सकते हैं।
ग्रेफाइट के सामान्य और औद्योगिक अनुप्रयोग क्या हैं?
ग्रेफाइट के कई उपयोग हैं। यह पेंसिल की नोक (लेड) में, स्नेहक (lubricants) के रूप में, इलेक्ट्रोड में, बैटरी में, और परमाणु रिएक्टरों में न्यूट्रॉन मंदक (moderator) के रूप में उपयोग किया जाता है। इसकी उच्च गलनांक (melting point) और चालकता के कारण यह धातुकर्म (metallurgy) में भी महत्वपूर्ण है।
क्या कार्बन के हीरा और ग्रेफाइट के अलावा भी कोई अन्य ज्ञात अपररूप हैं?
हाँ, हीरे और ग्रेफाइट के अलावा कार्बन के कई अन्य अपररूप भी हैं। इनमें फुलेरीन (जैसे बकमिनस्टरफुलेरीन या बकीबॉल), ग्राफीन (जो एकल-परत ग्रेफाइट है), और कार्बन नैनोट्यूब शामिल हैं। इन सभी की अपनी अनूठी संरचनाएँ और संभावित अनुप्रयोग हैं।